Por Rosana Souza-Lima e Wagner Souza-Lima
A hidrosfera compreende toda a água sobre a superfície terrestre, bem como aquela imediatamente abaixo, que compõe o lençol freático e as águas subterrâneas, e a água existente na atmosfera sob a forma de vapor d’água, pequenas gotículas ou minúsculos cristais de gelo. Assim, fazem parte da hidrosfera os oceanos, mares, rios, riachos, lagos, lagoas, neve, gelo e tudo o mais que apresenta a molécula H2O em sua forma livre, independente do estado físico.
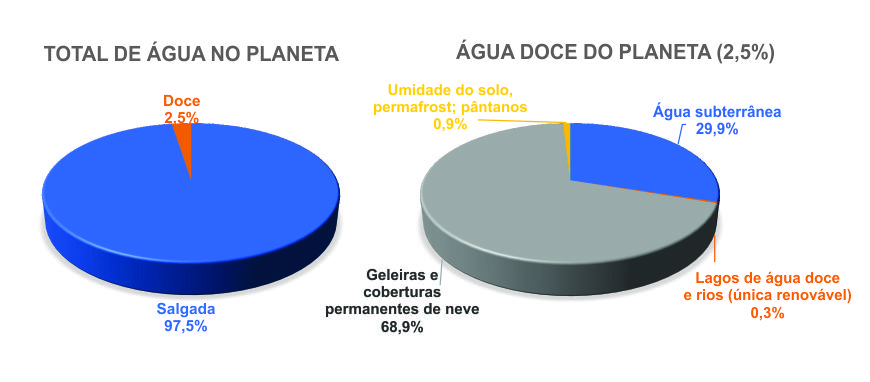
Quase 70% da superfície do planeta Terra é ocupada pela água, sendo os oceanos o maior componente, com quase 97% do total (Figura 1). Este é um dado importante – a maior parte da água existente na hidrosfera é salgada, ou seja, dispomos, de forma natural, de menos de 3% de água doce. Destes 3%, 68,9% compõem as coberturas de gelo das calotas polares e das geleiras das altas altitudes e latitudes, 29,9% estão representadas pelas águas subterrâneas, e 0,9% representa a umidade em solos, pântanos e permafrost (solo que permanece continuamente congelado). Resta-nos, então, apenas 0,3% da água doce na Terra de forma facilmente acessível, seja como rios, seja como lagos. Assim, quando usamos (e desperdiçamos) a água no nosso dia-a-dia, não nos damos conta de que estamos usando algo tão limitado, mas tão essencial para a nossa existência no planeta.
O uso racional da água é um tema tão crucial que a UNESCO possui um comitê criado especialmente para tratar do assunto – o “Programa hidrológico intergovernamental” (Intergovernmental Hydrological Programme – IHP), criado em 1975.
A água, em nosso planeta, está em constante movimento. Não apenas pelo movimento dos rios ou dos mares, mas pelos vários processos físico-químicos de evaporação, condensação, sublimação e precipitação, além dos processos de escoamento e infiltração. O conjunto desses fenômenos compõe o que denominamos de “ciclo da água”. Supõe-se que a hidrosfera componha um “sistema fechado”, ou seja, não há transferência de matéria para dentro ou fora do sistema. Isso implicaria em que a água da qual dispomos é a mesma que esteve à disposição do planeta desde a sua criação. Poluímos a água, destruímos as nascentes dos cursos d’água pelo desmatamento, desperdiçamos a água, fazemos um mal-uso desse recurso que parece grandioso em volume, mas que é muito, muito limitado.
Como pudemos ver no texto “A origem da vida”, as hipóteses mais prováveis sugerem que a vida teria surgido em meios aquosos. A água é fundamental para a existência dos seres vivos. Sem ela, morremos. As primeiras formas unicelulares ocorreram em meios aquosos. A vida multicelular também. Foi apenas após alguns organismos adquirirem a capacidade de serem compostos por várias células, que, com a evolução e adequação de tipos e conjuntos de células para desempenharem diferentes tarefas necessárias ao seu metabolismo, estes organismos puderam se “arriscar” a sobreviver fora da água. Primeiro habitaram as regiões adjacente aos cursos d’água e seus reservatórios. Depois, à medida em que suas estruturas se aprimoravam, puderam afastar-se paulatinamente cada vez mais para o interior das massas continentais, conquistando os mais diversos habitats.
Mas, afinal, porque ela seria tão importante para a vida? Para isso precisamos entender um pouco da química da água. Além de ocorrer em grande quantidade, nenhum processo metabólico ocorre sem a participação da água em alguma de suas etapas. E a água é uma molécula com propriedades muito especiais! Pequena, é formada por duas ligações covalentes entre o Oxigênio e o Hidrogênio, tendo a fórmula estrutural H – O – H. A ligação covalente ocorre pelo compartilhamento de pares de elétrons entre átomos. Como o oxigênio é mais eletronegativo que o hidrogênio, o núcleo do oxigênio atrai os elétrons mais fortemente que o núcleo do hidrogênio: isso faz com que o oxigênio seja mais negativo por ter os elétrons mais próximos, enquanto o hidrogênio é mais positivo por ter os elétrons mais afastados. Essa diferença torna a molécula de água uma molécula polar: uma molécula é polar quando os átomos que a constituem apresentam eletronegatividades diferentes. Dessa forma, o polo positivo de uma molécula atrai o polo negativo de outra molécula, formando pontes de hidrogênio por um processo chamado de atração eletrostática. Essas pontes são pouco estáveis e se formam e se quebram muito rapidamente, fazendo que as moléculas de água realizem muitas interações entre elas. Essas interações são responsáveis pelos estados físicos da água e são causadoras, por exemplo, dos fenômenos de capilaridade que fazem a água subir, contra a gravidade, pelo tronco de uma planta. Quando a água está no estado líquido faz aproximadamente três ligações de hidrogênio; em estado sólido pode fazer pontes de hidrogênio com até quatro outras moléculas. Pontes de hidrogênio também ocorrem nas ligações entre as bases nitrogenadas das duas fitas complementares da molécula do DNA.
A parte carregada da molécula de um soluto polar atrai eletricamente um dos polos da molécula de água e dessa forma fica envolto pela água, misturando-se homogeneamente a ela. Já um soluto apolar não apresenta regiões que possam interagir com a molécula de água, e vai se formar uma solução heterogênea, como quando algum óleo é misturado à água (figura 2). Isso ocorre pois como a água não faz ligações de hidrogênio com moléculas apolares, as moléculas de água acabam se dispondo ao redor da substância apolar para que possam fazer o máximo de pontes de hidrogênio possíveis, mantendo a substância apolar no centro. Para manter a energia do sistema estável as moléculas de água acabam levando as substâncias apolares a se agruparem. Diminuindo a superfície de contato entre substância apolar e água, diminuem as pontes de hidrogênio, diminuindo o gasto energético do sistema.

A polaridade é importante para manter a estrutura de todas as células, entre outras funções, pois as membranas celulares são formadas por fosfolipídeos que apresentam uma porção polar voltada para a água e uma apolar que fica longe da água. A estrutura de uma proteína também pode ser influenciada por sua polaridade, mantendo os aminoácidos polares ligados à água e os apolares “guardados” na parte de dentro da molécula proteica.
Outro efeito dessa polaridade é que a molécula da água atrai íons mais fortemente do que um íon consegue atrair outro, porque a molécula de água tem uma alta constante dielétrica. A constante dielétrica é a capacidade do solvente, nesse caso a água, de mascarar a intensidade do campo elétrico de qualquer partícula carregada que esteja imersa nela. Como a constante dielétrica da água é grande, os compostos iônicos ficam dissociados em uma solução aquosa porque um íon não consegue atrair outro com tanta força como a água atrai ambos. Isso faz com que a água seja um bom solvente e é fundamental para o metabolismo dos seres vivos, que na maior parte das suas células e órgãos têm íons em solução aquosa. Tendo facilidade para dissolver substâncias polares e iônicas, como sais e açúcares, a água facilita a interação química entre essas substâncias. A partícula iônica fica tão completamente cercada por água que essa camada externa de água, chamada camada de hidratação, passa a fazer parte do íon, aumentando seu tamanho. Um dos compostos mais importantes para os seres vivos é o NaCl, cloreto de sódio, que ficam dissociados e imersos na camada de hidratação quando estão em solução aquosa. Associada à polaridade, a condutividade da água também está relacionada a sua salinidade: quanto maior a quantidade de íons dissolvidos, maior será a condutividade elétrica na água. Isso é importante para os seres vivos porque todos nós funcionamos na base de troca de íons, o que, em alguns casos, pode ser afetado pela condutividade do meio.
Em qualquer massa grande de água, como em um riacho ou no oceano, podemos dizer que há moléculas mais internas e as mais externas. As moléculas da parte interna formam pontes de hidrogênio entre si e a força total resultante sobre cada molécula é nula. Já as moléculas da superfície da água estão em contato, por um lado, com outras moléculas de água, e pelo outro com moléculas dos gases que ocorrem no ar. Assim, haverá uma fraca atração das moléculas de água pelas moléculas dos gases, resultando na formação de uma fina membrana sobre a água, que dificulta a penetração dos gases e de outras pequenas partículas, formando uma área de tensão superficial. Alguns organismos leves conseguem, assim, ficar sobre a água, apoiados nessa barreira (figura 3).

A tensão superficial da água diminui à medida que a temperatura aumenta, e também depende da quantidade de substâncias orgânicas dissolvidas: corpos d’água eutrofizados (com intensa proliferação de algas) ou com muitas macrófitas aquáticas, podem ter menor tensão superficial. A poluição por esgotos domésticos, ricos em saponáceos e detergentes também podem afetar essa tensão. Veja nas embalagens desses produtos o aviso: “Contém substâncias tensoativas”.
No estado líquido a água possui maior densidade do que no estado sólido, e dessa forma o gelo flutua. Isso é muito importante para a vida dos organismos aquáticos das regiões mais frias do planeta. Flutuando sobre a água, o gelo funciona como um isolante térmico que mantém a água abaixo dele em estado líquido, permitindo a vida de muitos seres, mesmo em regiões sujeitas a congelamento superficial da água. A temperatura está relacionada à agitação de qualquer molécula: o calor aumenta e o frio diminui a agitação das moléculas. Com o clima frio, aumentam o número de pontes de hidrogênio, diminuindo a distância média entre as moléculas de água, que assim fica mais densa. Devido ao arranjo entre os átomos de oxigênio e hidrogênio a compactação da água é máxima a 4°C (maior densidade) e mínima à temperatura igual ou menor que 0°C (menor densidade). Dessa forma, a água com temperatura menor ou maior que 4°C é mais leve do que a esta temperatura. A densidade também é influenciada pela salinidade da água: quanto mais salgada, maior a densidade. Podemos testar isso facilmente percebendo que é mais fácil boiar no mar do que na piscina.
Outra característica da água é que seu calor específico é alto: dessa forma, a água pode absorver grandes quantidades de calor sem sofrer grandes alterações de sua temperatura. Quando uma panela com água é colocada no fogão, por exemplo, primeiro o bocal de chama do fogão se esquenta, depois a panela, e por fim, a água é aquecida. Essa propriedade da água garante boa estabilidade térmica dos ecossistemas aquáticos. A temperatura dos corpos de água, como rios e mares, varia pouco no espaço de um dia, ou até mesmo entre as estações, enquanto o ar pode apresentar grandes variações de temperatura diárias. Cada ser vivo funciona melhor a uma dada faixa de temperatura, e essa estabilidade é uma proteção importante para o metabolismo dos organismos aquáticos que, em muitos casos, são ectotermos, precisando de uma fonte externa de calor para manterem sua própria temperatura, e são também heterotermos: têm sua temperatura corporal dependente da temperatura do ambiente em que vivem. Por demorar a se aquecer, a água também tem um alto calor de vaporização: assim, os rios e mares absorvem muito calor da energia solar que chega à superfície da Terra para evaporar e formar as nuvens, e isso ajuda a regular a temperatura do planeta. Por isso é tão gostoso tomar um banho de mar ou de piscina em um dia quente: a água “rouba” calor do nosso corpo, nos mantendo mais frescos.
Você já deve ter percebido que é muito mais fácil andar na terra do que dentro da água. A viscosidade da água varia em função da temperatura e da salinidade, e é o que determina a resistência oferecida pela água ao movimento dos seres vivos e de partículas dissolvidas. A viscosidade aumenta com a diminuição da temperatura e diminui quando a temperatura aumenta: isso é importante para determinar o quanto de energia um organismo gasta para se manter na água. Mais um fator que influencia nessa localização dentro do ambiente é a pressão: quanto mais profundo o ambiente aquático, maior é a pressão a que está submetido. Subir à superfície depois de ter mergulhado a grandes profundidades precisa ser feito muito lentamente, para que os órgãos corporais cheios de gases, como pulmões de baleias, golfinhos e leões marinhos ou a bexiga natatória de peixes, por exemplo, que foram muito comprimidas à medida que afundaram, possam se expandir aos poucos, com a diminuição da pressão. Se a subida for muito rápida a rápida descompressão dos órgãos internos pode danificá-los e provocar a morte desses animais.
Será que você já tinha se dado conta de quantas características especiais essa molécula apresenta? Não é a toa que é uma das substâncias mais importantes para nossa vida nesse planeta. Vamos cuidar das nossas fontes de água!


